來源: EFL生物3D打印與生物制造
難愈合骨缺損(超過臨界尺寸的節(jié)段骨和骨質(zhì)疏松骨缺損等)由于內(nèi)源細胞的遷移受限或再生潛能較弱,,無法自行愈合,,其修復(fù)與功能重建是臨床上一個棘手的問題。由生物材料和健康細胞構(gòu)成的組織工程骨替代物為解決這一問題帶來了新的希望,。盡管過去二十年骨組織工程取得了巨大進展,,但仍未解決體外培養(yǎng)耗時且無法精準調(diào)控細胞分布等難題。擠出式生物3D打印技術(shù)可以實現(xiàn)細胞的精準投遞,,為個性化定制材料-細胞復(fù)合體提供有效途徑,。然而,如何平衡擠出打印過程細胞活性和支架力學(xué)穩(wěn)定性方面的難題,,既保證3D打印技術(shù)的精準度和支架尺寸,,同時還能維持負載細胞高存活率,具有較大的挑戰(zhàn)性,。
為了解決這一難題,,來自中國科學(xué)院深圳先進技術(shù)研究院阮長順團隊受到心臟搏動泵血的啟發(fā),,提出了一種力學(xué)輔助的“生物3D打印+”新策略,,首先結(jié)合3D打印構(gòu)建了具有力學(xué)響應(yīng)的大尺寸復(fù)雜結(jié)構(gòu)的中空纖維水凝膠支架,,然后利用支架力學(xué)響應(yīng)性能實現(xiàn)細胞快速、均勻,、精準及友好地加載,。基于該策略所獲得的細胞負載支架,,有效地促進了難愈合骨缺損的修復(fù)與功能重建,。該策略有效解決了當(dāng)前擠出式生物3D打印過程中如何平衡細胞活性和支架力學(xué)穩(wěn)定性方面的難題,為組織工程與再生醫(yī)學(xué)等領(lǐng)域提供新的思路,。
相關(guān)研究成果以“A mechanical-assisted post-bioprinting strategy for challenging bone defects repair”為題于2024年4月26日發(fā)表在《Nature Communications》上,。

640.jpg (69 KB, 下載次數(shù): 310)
下載附件
2024-5-14 17:23 上傳
1. 創(chuàng)新型研究內(nèi)容
本研究制備了一種可以對力學(xué)刺激做出可逆響應(yīng)的心臟啟發(fā)式結(jié)構(gòu)高度可調(diào)的中空纖維水凝膠支架(HHS),可實現(xiàn)快速,、均勻,、精準及友好地負載。采用甲基丙烯�,;髂z,、納米粘土和N-丙烯酰甘氨酰胺的混合墨水,通過一步式同軸打印,,在無任何內(nèi)核支撐材料的情況下,,實現(xiàn)高保真度和大尺寸HHS的構(gòu)建,且HHS具有均勻完整且結(jié)構(gòu)高度可調(diào)的中空纖維,。HHS表現(xiàn)出出色的彈性,、快速的形狀恢復(fù)和優(yōu)異的疲勞抗性,在壓縮應(yīng)變達80%下可以快速恢復(fù),,并且壓縮循環(huán)1萬次后仍能保持完整的結(jié)構(gòu),。此外,通過壓縮應(yīng)變,、循環(huán)次數(shù)可以實現(xiàn)對其力學(xué)響應(yīng)行為的調(diào)控,。HHS的力學(xué)響應(yīng)行為使其在力學(xué)刺激下實現(xiàn)細胞的快速(4 s)、精準和分區(qū)負載,。與靜態(tài)條件下相比,,HHS負載細胞數(shù)量提高了13倍。本研究進一步驗證了負載細胞的HHS對大鼠節(jié)段性和骨質(zhì)疏松骨缺損的修復(fù)效果,。結(jié)果表明,,負載細胞的HHS展現(xiàn)出令人滿意的治愈效果�,?偟膩碚f,,本研究工作為細胞和生物材料的功能組裝提供了一種新的、通用的,、高效的途徑,,推動組織工程及細胞治療用于再生醫(yī)學(xué)。
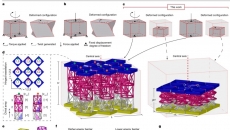
【大尺寸復(fù)雜結(jié)構(gòu)HHS構(gòu)建】
本研究基于同軸3D打印,,在沒有任何內(nèi)核支撐材料的情況下,,一步法直接構(gòu)建大尺寸復(fù)雜形狀的組織工程骨(圖1a, b)。采用具有優(yōu)異打印性,、足夠力學(xué)強度及生物相容性的甲基丙烯�,;髂z/硅酸鋰納米粘土/ N -丙烯酰甘氨酰胺復(fù)合材料作為打印墨水,經(jīng)同軸針頭的外殼擠出后紫外光照射固化,,獲得具有高保真度穩(wěn)定形狀的HHS,,可以懸浮在水中,中空通道清晰可見(圖1c),,表明構(gòu)建具有中空結(jié)構(gòu)的HHS可行性,。

640-1.jpg (119.94 KB, 下載次數(shù): 296)
下載附件
2024-5-14 17:22 上傳
圖1 “生物3D打印+”策略及組織工程骨支架構(gòu)建示意圖
【中空結(jié)構(gòu)和網(wǎng)格可調(diào)的HHS】
HHS的中結(jié)構(gòu)和網(wǎng)格具有高度可調(diào)控性,。如圖2a所示,,研究者定義了HHS中空纖維內(nèi)徑和外徑(分別為d和D)、同層兩根中空管之間的最近距離(L),、中空纖維的空間體積(V1)以及網(wǎng)格內(nèi)部的體積(V2),。如圖2b,c和d所示,可以清晰地觀察到光滑均勻的空心管,,空心結(jié)構(gòu)完整以及高保真度的網(wǎng)格,,其L、D和D具有廣泛的可調(diào)性,。通過GeSiM Robotics軟件可以輕松調(diào)節(jié)Lx,,而通過調(diào)節(jié)同軸噴嘴的內(nèi)外尺寸可以調(diào)節(jié)中空管的Dy(y范圍為0.4 ~ 0.8 mm)、dz(z范圍為0 ~ 0.6 mm)和壁厚Dy - dz(0 ~ 0.4 mm),,從而調(diào)控HHS的性能,,表明研究團隊打印的HHS具有出色的可設(shè)計性。

640-2.jpg (174.91 KB, 下載次數(shù): 290)
下載附件
2024-5-14 17:22 上傳
圖2 HHS可調(diào)的中空結(jié)構(gòu)和網(wǎng)格
【HHS的可壓縮性,、彈性,、形狀恢復(fù)性和疲勞抗性】
HHS具有優(yōu)異的壓縮性和回彈性,快速的形狀恢復(fù)以及優(yōu)異的抗疲勞性能,。研究者進一步通過壓縮和循環(huán)壓縮實驗,,全面研究了中空纖維內(nèi)徑d對HHS力學(xué)行為的影響。隨著d的增加,,HHs的壓縮強度和彈性提高,,即使在80%的應(yīng)變后仍然保持完整且可以恢復(fù)到初始狀態(tài)(圖3a),。此外,研究者通過螢光液體直觀地呈現(xiàn)了HHS的壓縮恢復(fù)速度,,一個周期的壓縮和形態(tài)恢復(fù)僅需要4 s,,且1 s內(nèi)即可快速恢復(fù),與心臟收縮和舒張搏動相似,。隨后,,在應(yīng)變?yōu)?0%的情況下,驗證了HHS的可重復(fù)性和抗疲勞性(圖3c,d),。無中空結(jié)構(gòu)的支架在102個循環(huán)后發(fā)生了嚴重的損傷,,而HHS在104個循環(huán)后保持結(jié)構(gòu)完整。結(jié)果表明,,HHS具有優(yōu)異的抗疲勞性能,。

640-3.jpg (193.06 KB, 下載次數(shù): 258)
下載附件
2024-5-14 17:22 上傳
圖3 HHS的力學(xué)性能
【HHS的力學(xué)響應(yīng)性】
HHS具有力學(xué)響應(yīng)行為,能夠快速響應(yīng)外界力學(xué)的刺激,。研究者為了進一步研究其力學(xué)響應(yīng)性,,將HHS浸泡在有或無力學(xué)刺激的水中,如圖4a,、b所示,,在沒有力學(xué)刺激的情況下,其吸水能力取決于網(wǎng)格而不是GLN水凝膠的溶脹或HHS的中空結(jié)構(gòu)(圖4c),。此外,,HHS吸水率隨應(yīng)變和循環(huán)次數(shù)的增加而顯著增加,而不含V1的HHS吸水率則保持恒定(圖4d-f),。此外,,L和d也會顯著影響HHS水吸收。此外,,在20%和40%的應(yīng)變下,,吸水率隨循環(huán)次數(shù)的增加而顯著增加(圖4f)。由此可見,,在動態(tài)力學(xué)刺激下,,V1使得HHS具有良好的力學(xué)響應(yīng)能力,且隨著d,、應(yīng)變和循環(huán)次數(shù)的增加,,其力學(xué)響應(yīng)能力增強。

640-4.jpg (175.5 KB, 下載次數(shù): 273)
下載附件
2024-5-14 17:22 上傳
圖4 HHS的力學(xué)響應(yīng)性
【HHS快速,、均勻,、精準及友好負載細胞的能力】
本研究基于HHS的快速壓縮恢復(fù)能力和優(yōu)異的力學(xué)響應(yīng)性,開發(fā)了一種力學(xué)輔助的“生物3D打�,。辈呗�,,以實現(xiàn)快速,、均勻、精確和友好的細胞負載,。如圖5a,b所示,,與靜態(tài)條件相比,4 s內(nèi)HHS負載的細胞數(shù)量顯著提高了約13倍,,這表明V1 -力學(xué)響應(yīng)途徑的主動性和有效性。培養(yǎng)3 d后,,HHS中細胞分布均勻且增殖明顯,。同時,HHS中負載細胞的數(shù)量隨著壓縮應(yīng)變(圖5c)或循環(huán)次數(shù)(圖5d)的增加而增加,,表明研究者提出的策略具有可控制性,。在傳統(tǒng)的組織工程中,無法將多種類型的細胞分區(qū)引入到支架中,。在本研究中,,利用V1和V2之間不同的力學(xué)響應(yīng)性,可以實現(xiàn)多個細胞的精確分區(qū)負載,。如圖5ei所示,,研究者進一步開發(fā)了一種簡單的V2-力學(xué)響應(yīng)途徑,與直接接種細胞相比,,細胞均勻分布在整個HHS的V2中(表面-中間-底部)(圖5eii,eiii)且HHS的V2中的數(shù)量提高了約200%(圖5eiv),。如圖5f所示,通過V1+V2-力學(xué)響應(yīng)的連續(xù)過程,,實現(xiàn)了兩種細胞分區(qū)負載于在V1和V2中,。此外,HHS可維持內(nèi)皮細胞表型和促進干細胞成骨分化(5g,h),。

640-5.jpg (219.58 KB, 下載次數(shù): 274)
下載附件
2024-5-14 17:22 上傳
圖5 HHS力學(xué)響應(yīng)負載細胞
【負載細胞的HHS修復(fù)難愈合骨缺損】
本研究進一步評估了負載細胞的HHS修復(fù)大鼠臨界節(jié)段性骨缺損和骨質(zhì)疏松骨缺損的能力,。對于大鼠大尺寸節(jié)段性骨缺損的修復(fù)(圖6),負載細胞的HHS相比于空白和HHS組術(shù)后6周顯著促進周圍新生血管的形成,,術(shù)后12周在股骨缺損的近端和遠端形成橋接,,且負載細胞的HHS新生骨量可達到HHS組的2.5倍。在大鼠骨質(zhì)疏松骨缺損修復(fù)方面,,術(shù)后4周和8周負載細胞的HHS組相比于空白和HHS組同樣呈現(xiàn)更為優(yōu)異的骨再生能力(圖7),。研究表明,對于難愈合骨缺損而言,,結(jié)合細胞的HHS在骨缺損的修復(fù)與功能重建方面顯示出令人滿意的治療效果,。

640-6.jpg (226.88 KB, 下載次數(shù): 286)
下載附件
2024-5-14 17:22 上傳
圖6 負載細胞的HHS修復(fù)大鼠大尺寸節(jié)段骨缺損的研究

640-7.jpg (233.55 KB, 下載次數(shù): 283)
下載附件
2024-5-14 17:23 上傳
圖7 負載細胞的HHS修復(fù)骨質(zhì)疏松大鼠骨缺損的研究
2. 總結(jié)與展望
總之,本研究通過一種簡單的一步同軸打印方法,,在無內(nèi)核支撐材料的情況下,,成功3D打印制備了一系列中空纖維結(jié)構(gòu)高度可調(diào)的大尺寸復(fù)雜結(jié)構(gòu)HHS,。所得到的HHS表現(xiàn)出優(yōu)異的彈性、快速的形狀恢復(fù)和出色的疲勞抗性,,并顯示出可控的力學(xué)響應(yīng)行為,。利用HHS力學(xué)響應(yīng)性能可實現(xiàn)細胞快速、均勻,、精準及友好地加載,。所獲得的細胞負載HHS,有效地促進了難愈合骨缺損的修復(fù)與功能重建,,推進了組織工程在骨再生領(lǐng)域的應(yīng)用,。本研究提出的力學(xué)輔助“生物3D打印+”新策略,,有效解決了當(dāng)前擠出式生物3D打印過程中難以平衡細胞活性和支架力學(xué)穩(wěn)定性方面的難題,,為細胞和生物材料的功能組裝提供了一種新的、通用的,、高效的途徑,,推動組織工程及細胞治療用于再生醫(yī)學(xué)。
文章來源:https://doi.org/10.1038/s41467-024-48023-8
|