來源: EFL生物3D打印與生物制造
皮膚健康問題是2型糖尿病的首發(fā)可見癥狀,。2型糖尿病可導致一系列的皮膚問題,,比如:糖尿病皮膚病,、水泡、皮疹,、瘙癢和真菌感染等,。這種情況發(fā)生在機體對胰島素無法正常反應或不能產(chǎn)生足夠的胰島素來維持正常的血糖水平時。特別是長期糖尿病并發(fā)癥合并高血糖狀態(tài),。進入皮膚的血液循環(huán)減少會損害細胞功能,,最終導致自我修復困難。由于傷口愈合的延遲,皮膚損傷的糖尿病人患者具有高感染風險,。14% - 24%的患者需要截肢,,其中85%是在腳底(稱為糖尿病足潰瘍)。盡管如此嚴重,,據(jù)報道糖尿病相關(guān)的皮膚病仍然沒有很好的治療方法,。
前人主要應用糖尿病動物模型來進行糖尿病皮膚病的研究,但是動物模型的倫理問題以及動物基因組與人類基因組的差異導致該模型并不能十分合理的預測其方法的準確性,。近期,,來自韓國浦項科技大學的Dong-Woo Cho教授團隊在Biomaterials上發(fā)表了題目為Engineering of diseased human skin equivalent using3D cell printing for representing pathophysiological hallmarks of type 2diabetes in vitro的文章,應用3D打印技術(shù)體外構(gòu)建了具有糖尿病病理特征的皮膚模型,。
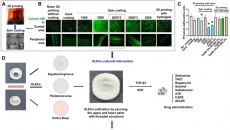
盡管已有許多關(guān)于體外構(gòu)建皮膚模型的成果,,但未有人報道過體外皮膚疾病模型。因此,,研究人員通過3D細胞打印主要皮膚層(表皮,、真皮層、皮下組織和血管)和利用天然皮膚中發(fā)現(xiàn)的生理現(xiàn)象來建模具有明確2型糖尿病屬性的患病皮膚,。圖1顯示了這項研究的一些重點和工作流程,。

640.jpg (142.95 KB, 下載次數(shù): 100)
下載附件
2024-3-15 17:34 上傳
圖1 本研究的一些重點和工作流程
盡管3D皮膚打印技術(shù)已取得了許多重大進展,但尚未有皮膚病理模型報道,。因此,,研究人員基于3D細胞打印技術(shù)在體外建立具有2型糖尿病病理生理特征的3D病變皮膚組織。為了克服糖尿病角質(zhì)形成細胞分化能力差的問題,,研究人員利用在天然皮膚中發(fā)現(xiàn)的表皮-真皮胞間通訊的作用,,假設(shè)糖尿病成纖維細胞(dHDFs)可以誘導正常角質(zhì)形成細胞(nHEKs)成為糖尿病型表皮細胞。為了證明這一假設(shè),,研究人員分離dHDFs,,并從組織學和基因表達的角度進行分析。研究人員首次將可打印聚己內(nèi)酯(PCL)納入3D細胞打印的損傷皮膚模型中,,使之成為一個3D transwell系統(tǒng),。在糖尿病皮膚模型中觀察到糖尿病皮膚的重要特征:延遲再上皮化。為了進一步增強結(jié)構(gòu)相似性和糖尿病特性,,該研究在真皮層下面添加了含有糖尿病人脂肪細胞和可灌注血管通道的皮下層。在該糖尿病皮膚模型中發(fā)現(xiàn)了胰島素抵抗增加,、血管功能障礙,、脂肪肥大和促炎癥反應等糖尿病特征。最后,,為了證明構(gòu)建的糖尿病皮膚在皮膚病學研究和藥物測試方面的潛在應用,,研究人員將試驗藥物(二甲雙胍/EPA)應用于血管通道3天。觀察表皮的功能恢復和炎癥反應的減少。

640-1.jpg (96.17 KB, 下載次數(shù): 85)
下載附件
2024-3-15 17:34 上傳
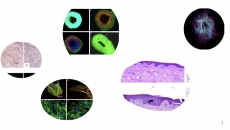
圖2分析dHDFs與nHDFs細胞之間的差異:nHDFs較dHDFs的遷移能力強,,COL I表達量更高,。

640-2.jpg (162.75 KB, 下載次數(shù): 68)
下載附件
2024-3-15 17:34 上傳
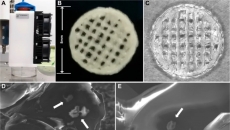
圖3 利用3D打印技術(shù)結(jié)合PCL小室構(gòu)建正常皮膚模型和糖尿病皮膚模型:圖A-B顯示成熟3D皮膚模型及其HE染色結(jié)果,據(jù)統(tǒng)計,,糖尿病皮膚的表皮厚度較正常皮膚模型表皮厚度薄1.52倍,;圖D利用基因分析技術(shù)統(tǒng)計了分化標記物(K10: keratin10, IVL: involucrin) 和糖尿病相關(guān)標記物表達量之間的差異(IR: Insulin receptor,TNF-α: tumor necrosis factor-alpha),符合糖尿病皮膚的蛋白表達狀態(tài),;圖E結(jié)果顯示,,由dHEKs和dHDFs組成的皮膚模型的接觸角(測量值約為21°)與糖尿病皮膚模型的接觸角(測量值約為19°)沒有差異;圖F-H表明糖尿病模型創(chuàng)口恢復能力延遲,,符合糖尿病皮膚特征,。

640-3.jpg (195.71 KB, 下載次數(shù): 78)
下載附件
2024-3-15 17:34 上傳
圖4 應用同軸擠出打印方式在3D打印糖尿病皮膚模型中添加血管結(jié)構(gòu),并在結(jié)構(gòu)下方增加皮下脂肪層結(jié)構(gòu):圖A顯示整體打印流程,;圖B顯示灌流過程,;圖C顯示其內(nèi)部形成的血管結(jié)構(gòu);圖D顯示葡萄糖攝取結(jié)果,,糖尿病皮膚模型有胰島素抵抗現(xiàn)象,;圖E顯示在高糖狀態(tài)下,脂肪細胞中脂滴更大,;圖F顯示不同糖濃度培養(yǎng)條件下TNF-α,、IL-6、ROS的表達量隨時間逐漸增加,,高糖環(huán)境三者的表達量更高,;圖G表示 FITC標記的右旋糖酐注入血管流道10分鐘。熒光圖像顯示高糖狀態(tài)下糖尿病皮膚模型較正常皮膚模型具有較低擴散滲透性,。這表明內(nèi)皮屏障將被建立的高血糖條件削弱,。該模型可以通過高血糖條件進一步反映糖尿病的主要特性,包括脂肪細胞萎縮,、血管功能障礙,、炎癥反應和胰島素抵抗。

640-4.jpg (107.25 KB, 下載次數(shù): 89)
下載附件
2024-3-15 17:34 上傳
圖5 糖尿病皮膚模型的潛在應用探索,。將二甲雙胍或二十碳五烯酸(EPA)通過血管組織進行灌流操作,;機制層面:由于鞘糖脂累積,糖尿病角質(zhì)細胞層的胰島素受體(IR)會關(guān)閉,。圖C共聚焦圖片顯示胰島素受體磷脂(p-IR)在經(jīng)過二甲雙胍處理后與正常水平相似,。圖D葡萄糖攝取實驗顯示實驗組中存在胰島素抵抗現(xiàn)象;圖E表示在EPA治療后糖尿病皮膚模型的炎癥反應降低,。
本文首次應用3D打印技術(shù)構(gòu)建糖尿病皮膚模型,,并通過胞間通訊的作用原理利用dHDFs將nHDFs誘導成為dHDFs,使之成為與糖尿病患者皮膚類似的體外病理模型。通過添加皮下脂肪層與血管結(jié)構(gòu)構(gòu)建灌流通道,,為后續(xù)藥物評估建立便捷條件,。增強的糖尿病皮膚模型包括糖尿病的典型特性,如胰島素抵抗,、脂肪細胞肥大,、炎癥反應和血管功能障礙。此外,,研究人員通過將糖尿病相關(guān)藥物導入皮膚模型的工程血管,,驗證了其作為藥物篩選和新進展的疾病模型的可行性。
文章來源:
https://doi.org/10.1016/j.biomaterials.2021.120776
|