�����ˣ�����R���� �����λ��������ͨ��W(xu��)�C(j��)е����ϵ�y(t��ng)���̇������c(di��n)�����
�S��3D�M��ģ��������W(xu��),���t(y��)�W(xu��)��ˎ�W(xu��)�I(l��ng)����d��,���˂�Խ��Խ���R�����y(t��ng)2D��(x��)�����B(y��ng)���g(sh��)�ľ����ԣ����3D�M��ģ�Ϳ��ԫ@�ø���(zh��n)�_�ĽY(ji��)��,���@��Ҫ��ه�����܄�(chu��ng)�����挍�ļ�(x��)���h(hu��n)��,�����3D�M��ģ���еļ�(x��)���g�Ͱ��|(zh��)�g������c�w��(n��i)�l�����ӽӽ��������@Щ�˹�3D�M��Ҳ���ܱ����������t(y��)�W(xu��)�ĽM�������,��Ȼ��,�����ڼ�(x��)�����|(zh��)�ͼ�(x��)���ܶȵ����ƣ���(chu��ng)���ߴ���0.6mm-1mm֮�g���˹�3D�M��ģ����Ȼ��һ���P(gu��n)�I������(zh��n),������,���˹�3D���|(zh��)��(y��ng)�M����ģ�M��(f��)�s�ļ�(x��)������ã������M(j��n)��(x��)����3D�h(hu��n)���еĸ���,��������ֳ,��
ᘌ��������}���S���ı���W(xu��)���ܲ����c���������о������о��ˆT��������ß������ϵĠ���֧��,������������ˮ���z���������Ѫ�ܾW(w��ng)�j(lu��)�Y(ji��)��(g��u)���������,��ʹ�������o늴�ӡ���g(sh��)��ӡ�ɠ�����������֧�ܣ�������и߾�������ģ��,��ʹ��ˮ���zǰ�w��Һ��25���������,������25�������cˮ���z�ں��γɸ߾��ȵĿɹ�ע����Ѫ�ܾW(w��ng)�j(lu��)��������ķֲ�Y(ji��)��(g��u)ƽ��ֱ����87��m-275��m֮�g,������ͨ�^��������(n��i)��ע��(x��)��,�������������(n��i)�����γɾo���Ҿ������﹦�ܵă�(n��i)Ƥ�ӡ�
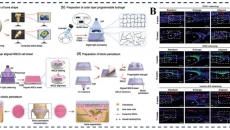
�о��ˆTͨ�^ʹ�ò�ͬ���@���g(sh��)��������(n��i)��(x��)���ļ�(x��)����,��CD31��F-actin�M(j��n)��Ⱦɫ���u��,���ԙz�y��(x��)���ΑB(t��i)��3D������(n��i)����׃������r���Y(ji��)���@ʾ��(x��)���������ڹ�ǻ����,���Ҽ�(x��)����(sh��)���^��(�D1A),�����ҿ��Կ�����(n��i)Ƥ��(x��)���γɵă�(n��i)Ƥ�ΌӾ����M��������(�D1B)�,����ڃ�(n��i)Ƥ�����������Sģ���ؽ�,���о��ˆT߀���ֲ������ļ�(x��)�����B(y��ng)���M(j��n)���˔�(sh��)ֵ����ģ�M(�D1C)��������ʾ���|(zh��)ͨ�^��֧�r�mȻ�ٶ���������,�������]���@��Ӱ푱ڼ���(y��ng)��,��ͨ�^�����в�ͬ�ֲ�Ƕȵ������е����w�M(j��n)�Д�(sh��)ֵģ�M�������˷ֲ�ǶȌ����N��ͬͨ���O(sh��)Ӌ��Ӱ�(�D3D),�������������w�ٶȺͼ���(y��ng)���������S���ֲ�Ƕȵ����Ӷ��@����׃,��

pic1849.jpg (183.23 KB, ���d��(sh��): 106)
���d����
2023-3-21 18:03 �ς�
�D 1 ������(n��i)Ƥ���ı�����(A)������ǻ��CD31��ԃ�(n��i)Ƥ�Όӵ�3D�D��,��(B)���Ѓ�(n��i)Ƥ�ӵ����������Ķ���ӳ���,��(C)Ƕ��Ѫ�������ӵĔ�(sh��)ֵ����,������(B)�Ѓ�(n��i)Ƥ����Ʒ�Ď�����,����3Dģ���й�ע��(x��)�����B(y��ng)��������������T��(d��o)�ڼ���(y��ng)��,��(D)�ھ��в�ͬ�ֲ�Ƕȵ������ą���(sh��)�����S�O(sh��)Ӌ�У�Ӌ��ѪҺ��ע������������T��(d��o)�ڼ��Б�(y��ng)��,��
�����о���(n��i)Ƥ�ӵ�ͨ��,���о���ʹ���˃ɷN��ͬ�߶ȵĮ�������ɹ��ؘ�(bi��o)ӛ���Ͼ��ǣ��քe��20kDa��200kDa,����ע���Ͼ����_ʼ�r��2С�r��քe�^������ˮ���z���|(zh��)�еĔU(ku��)ɢ��r(�D2A),��ͨ�^�y����(n��i)Ƥ���c�ǃ�(n��i)Ƥ��������(n��i)���܇�ˮ���z���|(zh��)�еğɹ⏊(qi��ng)�ȣ����u����(n��i)Ƥ���ṩ�����Ϲ���,���Y(ji��)��������(n��i)Ƥ�ӵĴ��ڴ��p���˃ɷN�߶��Ͼ�����ˮ���z���|(zh��)�еĔU(ku��)ɢ�̶�(�D2B),��ע��20kDa��200kDa�Ͼ��Ǻ��c�ǃ�(n��i)Ƥ���������,����(n��i)Ƥ���������^�쵽�����܇�ˮ���z�ĔU(ku��)ɢ�p���˼s25%��30%(�D2C, D),���Y(ji��)������������(n��i)�ă�(n��i)Ƥ������ģ�MѪ�ܵ����Ϲ��ܡ�

pic1850.jpg (98.9 KB, ���d��(sh��): 87)
���d����
2023-3-21 18:03 �ς�
�D 2 �ɹ��(bi��o)ӛ�Ͼ��Ǚz��������(n��i)��(n��i)Ƥ��ͨ��,��(A)�������й�ע�Ͼ��Ǻ�0 - 2С�r�ğɹ�D��,����20kD�Ͼ��ǣ��ң�200kDa�Ͼ���,��(B)�Пo��(n��i)Ƥ��ͨ���g�U(ku��)ɢ���ʵı��^���Ͼ��Ƿ��ӔU(ku��)ɢ��ˮ���z�еğɹ⏊(qi��ng)��,��(C, D)�ɷN�߶��Ͼ��ǔU(ku��)ɢ�İٷֱ�Ӌ�㡣
�M��ԓ�����ɹ������˾��Ѓ�(n��i)Ƥ���ܵĿɹ�ע����Ѫ�ܾW(w��ng)�j(lu��),������Ȼ����Ҫ���M(j��n)�ĵط�,�����磬�������o늴�ӡ���Ŀɠ���֧�������ˮ���zǰ�w��Һ�r,������֧�ܵ����W(xu��)�����^��,���o���S�ִ�ӡ֧�ܵ��Π��(d��o)�������ĽY(ji��)��(g��u)�o�������A(y��)�ڵ��O(sh��)����ˮ���z���γ�,����(d��ng)�����(f��)�s�Y(ji��)��(g��u)�������r���o�����C���������ij��;���,����δ��,������ͨ�^��׃���ϵČ��Ժ����cˮ���zǰ�w��Һ�ĽY(ji��)�Ϸ�ʽ�˷��@Щ���}��ͨ�^�c����ϴ�ӡ��Y(ji��)��,��������;��ȸ���,����(w��n)���Ը��õ��˹�3D�M��ģ�͡�
�����īI(xi��n)��
Ryma, M., Genç, H., Nadernezhad, A., Paulus, I., Schneidereit, D., Friedrich, O., Andelovic, K., Lyer, S., Alexiou, C., Cicha, I., Groll, J., A Print-and-Fuse Strategy for Sacrificial Filaments Enables Biomimetically Structured Perfusable Microvascular Networks with Functional Endothelium Inside 3D Hydrogels. Adv. Mater. 2022, 34, 2200653. https://doi.org/10.1002/adma.202200653
|