來源: EngineeringForLife
骨缺損治療的支架應(yīng)支持血管化和促進(jìn)骨形成,,以促進(jìn)轉(zhuǎn)化為生物醫(yī)學(xué)設(shè)備應(yīng)用,。目前用于骨缺損治療和骨再生的生物材料支架迫切需要改進(jìn),以增強(qiáng)組織整合,、血管化和骨形成,,同時最小化材料的復(fù)雜性。但傳統(tǒng)支架在提供足夠的通道結(jié)構(gòu)以有效的營養(yǎng)供應(yīng)和廢物清除方面往往面臨限制,,因此含有通道的生物材料支架已經(jīng)成為一種潛在的解決方案,。基于此,,澳大利亞莫納什大學(xué)Neil R. Cameron,、Mikaël M. Martino提出了一種新方法,利用3D打印水溶聚乙烯醇(PVA)犧牲模具,,設(shè)計(jì)具有微通道和多尺度孔隙率的聚合高內(nèi)相乳液(polyHIPE)支架,。使用熔融沉積模型生成兩個犧牲模具變體(250 μm和500 μm),填充HIPE,,隨后溶解以生成含有微通道的polyHIPE支架,。體外評估顯示,細(xì)胞浸潤,、增殖和成骨分化顯著增強(qiáng),,強(qiáng)調(diào)微通道對細(xì)胞行為的良好影響。成骨因子BMP-2實(shí)現(xiàn)較高的負(fù)載效率和可控釋放,,微通道促進(jìn)生長因子的釋放,。對小鼠臨界大小的顱骨缺損模型的評估顯示,在含有BMP-2的微通道支架中,,血管化和骨形成增強(qiáng),。綜上,本研究不僅介紹了一種在polyHIPE支架中創(chuàng)建多尺度孔隙率的可行方法,,而且強(qiáng)調(diào)了其增強(qiáng)細(xì)胞浸潤、控制生長因子釋放和體內(nèi)性能的能力,。以上發(fā)現(xiàn)表明,,polyHIPE支架在骨組織工程和再生醫(yī)學(xué)中有很好的應(yīng)用前景,并有望促進(jìn)這類生物材料支架的轉(zhuǎn)化,。
相關(guān)研究內(nèi)容以“Bioactive Polymer Composite Scaffolds Fabricated from 3D Printed Negative Molds Enable Bone Formation and Vascularization”為題于2024年7月30日發(fā)表在《Acta Biomaterialia》,。

640.jpg (164.15 KB, 下載次數(shù): 118)
下載附件
2024-8-15 11:24 上傳
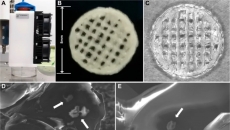
圖1 含微通道的多孔DPEHA支架制備
PVA細(xì)絲的3D打印產(chǎn)生在水平面上0、90度觀察到層狀垂直支柱,,支柱直徑分別為250 μm和500 μm(圖1A),。在高內(nèi)相乳液(HIPE)紫外光聚合、負(fù)模溶解和支架脫水之后,由此產(chǎn)生的微通道穿過垂直軸和水平軸上在整個支架相互連接(圖1B),。SEM圖像顯示,,兩個支架通道表面上有小開孔,直徑為250 μm(250μC)和500 μm(500μC)的微通道,。

640-1.jpg (217.14 KB, 下載次數(shù): 124)
下載附件
2024-8-15 11:24 上傳
圖2 多尺度孔隙度DPEHA polyHIPE支架的形態(tài)學(xué)特征
PolyHIPE材料的形態(tài)學(xué)特征在所有三種支架變化中都很明顯,,如圓形和清晰的孔隙(圖2 A)。對支架材料孔徑直徑的測量表明,,所有材料的孔尺寸都相似且正偏態(tài)分布,,表明犧牲模板對內(nèi)孔隙直徑的分布沒有顯著影響(圖2B)。

640-2.jpg (86.34 KB, 下載次數(shù): 133)
下載附件
2024-8-15 11:24 上傳
圖3 含/不含微通道的DPEHA polyHIPE支架的力學(xué)表征
支架的壓縮模量,、極限壓縮屈服強(qiáng)度和應(yīng)力-應(yīng)變曲線的測量值如圖3所示,。結(jié)果顯示,-μC,、250μC和500μC支架之間的壓縮模量沒有顯著差異(圖3A),。與非通道材料相比,250μC和500μC支架的極限抗壓強(qiáng)度均顯著降低(圖3B),。所有支架變化的應(yīng)力-應(yīng)變曲線均顯示出韌性材料具有相當(dāng)大的彈性變形特征(圖3C),,其J形非線性曲線代表polyHIPEs和其他生物材料的拉伸試驗(yàn)應(yīng)力-應(yīng)變曲線。250μC和500μC支架在給定的應(yīng)變值下均表現(xiàn)出較低的應(yīng)力值,,表明隨著在材料中引入微通道,,機(jī)械響應(yīng)發(fā)生改變。

640-3.jpg (219.1 KB, 下載次數(shù): 149)
下載附件
2024-8-15 11:24 上傳
圖4 多尺度孔隙度DPEHA polyHIPEs支架的體外評價
為了研究支架中的微通道是否能增強(qiáng)細(xì)胞在生物材料內(nèi)部的遷移和定植,,本研究將MG63骨肉瘤細(xì)胞接種到支架表面,,培養(yǎng)長達(dá)28天(圖4A)。H&E染色顯示,,與非通道支架相比,,細(xì)胞浸潤到更多的內(nèi)部區(qū)域;相反,,在沒有通道的支架中,,只有少數(shù)細(xì)胞浸潤到靠近支架表面的空隙中(圖4B)。SEM證實(shí)在單個通道內(nèi)存在細(xì)胞,,并觀察到密集的ECM層在通道表面和空間上擴(kuò)散(圖4C),。用刃天青還原試驗(yàn)測定支架培養(yǎng)4周后,支架中的細(xì)胞活力和增殖情況(圖4D),。結(jié)果與組織學(xué)結(jié)果一致,,支架在整個培養(yǎng)期間均表現(xiàn)出高活力。

640-4.jpg (59.5 KB, 下載次數(shù): 137)
下載附件
2024-8-15 11:24 上傳
圖5 DPEHA polyHIPE支架中BMP-2的負(fù)載效率和累積釋放譜
接下來,,本研究探索了負(fù)載BMP-2的polyHIPE支架的加載和釋放,,以估計(jì)植入后可能發(fā)生的釋放譜,。在所有支架中均觀察到相對較高的加載效果,-μC,、250μC和500μC通道支架的負(fù)載效率無顯著差異(圖5A),。在最初的24小時內(nèi),所有的支架均表現(xiàn)出總負(fù)載BMP-2的低突發(fā)釋放,,500μC支架的BMP-2累積釋放百分比最高,,其次是250μC,-μC支架的釋放譜最低(圖5B),。

640-5.jpg (154.98 KB, 下載次數(shù): 126)
下載附件
2024-8-15 11:24 上傳
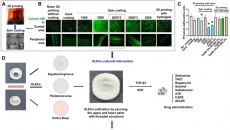
圖6 微通道DPEHA polyHIPE支架中MSC的浸潤和成骨分化
微通道PolyHIPE支架沉積在MSC單層上,,將細(xì)胞在含有BMP-2的成骨分化培養(yǎng)基中培養(yǎng)3周(圖6A)。在培養(yǎng)的第21天,,H&E染色顯示,,與非通道PolyHIPE支架相比,微通道PolyHIPE支架中的細(xì)胞浸潤到更多的內(nèi)部區(qū)域(圖6B),。此外,,通道支架中較高的細(xì)胞浸潤翻譯較高水平的晚期成骨細(xì)胞分化標(biāo)志物骨鈣素(圖6C、D),。

640-6.jpg (250.32 KB, 下載次數(shù): 147)
下載附件
2024-8-15 11:24 上傳
圖7 DPEHA polyHIPE支架植入顱骨缺損的血管化研究
本研究通過微注射MV-122,,結(jié)合高分辨率X線CT,觀察犧牲模板polyHIPE支架獲得的三維血管網(wǎng)絡(luò),。血管包圍非負(fù)載支架的表面并靠近上下表面,,包圍了polyHIPE支架的側(cè)面。-μC/- BMP-2支架的血管主要在支架外表面,。相比之下,,250μC/-BMP-2和500μC/-BMP-2支架在整個支架上都有廣泛的、相互連接的血管浸潤(圖7A,、B),。

640-7.jpg (199.76 KB, 下載次數(shù): 137)
下載附件
2024-8-15 11:24 上傳
圖8 微通道DPEHA polyHIPE支架誘導(dǎo)骨形成的定量研究
接下來,用較低分辨率(20 μm)的顯微CT掃描植入物,,以量化支架誘導(dǎo)的新骨生長(圖8 A),。在沒有BMP-2的支架中,非通道組和通道組在缺損覆蓋,、新骨總體積和垂直骨增加方面沒有顯著差異,,而所有BMP-2組均表現(xiàn)出更大的缺損覆蓋范圍和更多新骨形成(圖8B、D),。此外,與通道較小的支架相比,,通道較大的支架骨形成顯著增加(圖8C),。與有BMP-2但沒有微通道的支架相比,,有BMP-2和微通道的支架的骨增強(qiáng)量增加近10倍(圖8D),表明微通道顯著促進(jìn)新骨形成,。然后對顱骨組織進(jìn)行組織學(xué)處理,,用Masson染色以進(jìn)一步檢查polyHIPE支架內(nèi)的新骨形成和細(xì)胞浸潤(圖8E)。
全文小結(jié)
綜上所述,,本研究將乳劑模板與可提取的3D打印結(jié)合,,制備了用于骨組織工程的具有多孔孔隙度的聚合物支架。所得到的支架有一個由乳化液模板產(chǎn)生的完全互聯(lián)的微孔網(wǎng)絡(luò),,以及一個直徑為250或500 μm的相互連接的網(wǎng)狀微通道網(wǎng)絡(luò),。在體外,骨肉瘤細(xì)胞(MG63)能夠更好地穿透微通道支架并填充支架內(nèi)部,。同樣,,骨源性MSCs可以從單層培養(yǎng)向上遷移到非通道支架中,增殖并顯示成骨標(biāo)記物,。小鼠顱骨缺損模型結(jié)果表明,,當(dāng)添加骨誘導(dǎo)因子BMP-2時,微通道支架的骨誘導(dǎo)作用更大,,以及微通道支架促進(jìn)血管化,。在500μm+ BMP-2中,8周后顱骨缺損幾乎完全閉合,�,?傊狙芯拷Y(jié)果表明,,乳劑模板和負(fù)模通道的結(jié)合產(chǎn)生了很有前途的骨組織工程支架,。
文章來源:
https://doi.org/10.1016/j.actbio.2024.07.038
|