來源:生物打印與再生工程
脫細(xì)胞基質(zhì)(Decellularized matrix,dECM)水凝膠是一種具有與天然組織器官近似復(fù)雜生化信號(hào)分子的親水三維網(wǎng)絡(luò)結(jié)構(gòu),被認(rèn)為是組織器官修復(fù)/制造的理想材料。其主要成分包括蛋白質(zhì)、糖胺聚糖、蛋白聚糖等,可以支持細(xì)胞3D培養(yǎng)、提供生化物理信號(hào)并與細(xì)胞動(dòng)態(tài)互惠。近年來,該材料的成型加工是研究的熱點(diǎn)之一,本專題主要總結(jié)了脫細(xì)胞基質(zhì)在低維和三維結(jié)構(gòu)的生物制造手技術(shù)與應(yīng)用。
一、dECM的低維結(jié)構(gòu)制造
研究表明dECM可為細(xì)胞重建組織特異性的細(xì)胞微環(huán)境,促進(jìn)細(xì)胞功能成熟,因此常作為提高細(xì)胞生物相容性、調(diào)節(jié)細(xì)胞行為的功能性材料在低維結(jié)構(gòu)中發(fā)揮重要作用。
1. Journal of Materials Chemistry B 2018:dECM涂層技術(shù)【1】
簡(jiǎn)介:
韓國(guó)浦項(xiàng)科技大學(xué)Dong-woo cho教授團(tuán)隊(duì)將豬脛骨前肌組織經(jīng)1%十二烷基硫酸鈉(SDS)、50U/ml DNAse、1U/ml RNAse和0.5%Triton X-100處理后制備得到肌肉脫細(xì)胞基質(zhì)(mdECM),并溶解于含胃蛋白酶的0.5M醋酸中得到水凝膠前體(Pre-gel)。Pre-gel經(jīng)中和后涂敷在由X射線LIGA技術(shù)制造的正弦波狀(20、40、80mm)聚苯乙烯結(jié)構(gòu)表面形成凝膠涂層,種植小鼠C2C12細(xì)胞培養(yǎng)7天后,評(píng)估肌管的形成情況。結(jié)果顯示間距為80mm的正弦波狀表面上觀察到排列良好的肌管,并接近天然肌纖維的寬度(~100 mm)。dECM涂層表面細(xì)胞粘附、細(xì)胞活力、肌管形成和肌源性基因表達(dá)(提高1.5-2倍)水平顯著高與膠原蛋白涂層。

640.png (10.41 KB, 下載次數(shù): 127)
下載附件
2022-10-24 18:09 上傳
2. Composites Part B: Engineering 2022:dECM靜電紡絲膜制造技術(shù)【2】
簡(jiǎn)介:
由于骨膜脫細(xì)胞基質(zhì)(pdECM)的形狀、完整性、均勻性和尺寸的控制難度較高,不能為臨床骨缺損修復(fù)提供適合的治療。基于此,廣東省人民醫(yī)院口腔科周苗教授團(tuán)隊(duì)把pdECM粉末溶解在六氟異丙醇中,利用同軸靜電紡絲將聚己內(nèi)酯(PCL)/pdECM復(fù)合制備出具有骨膜特異性生化信號(hào)分子和定制物理化學(xué)特性的組織工程骨膜(TEP)以促進(jìn)骨缺損愈合。結(jié)果表明TEP具有良好的生物降解率,可避免感染、重建失敗和影響新生組織長(zhǎng)入等問題。與純PCL相比,TEP可促進(jìn)hBMDCs的增殖、基質(zhì)成熟及成骨分化。與純ECM相比,PCL核心可提供TEP較好的機(jī)械強(qiáng)度促進(jìn)細(xì)胞的成骨分化并延長(zhǎng)降解速率。

640-1.png (23.26 KB, 下載次數(shù): 148)
下載附件
2022-10-24 18:09 上傳
3. Macromolecular Bioscience 2022:dECM噴霧技術(shù)【3】
簡(jiǎn)介:
安卡拉大學(xué)Burak Derkus教授團(tuán)隊(duì)利用噴霧技術(shù)將骨脫細(xì)胞基質(zhì)(bdECM)水凝膠前體溶液噴涂在聚己二酸/對(duì)苯二甲酸丁二醇酯(PBAT)電紡膜上,置37℃孵育1h后取出電紡膜并清理多余的dECM材料。將人胎兒成骨細(xì)胞(hFOBs)種植在電紡膜表面,觀察細(xì)胞行為。結(jié)果顯示纖維定向排布并且噴涂dECM的PBAT電紡膜表面hFOBs的骨相關(guān)基因表達(dá)上調(diào)。

640-2.png (32.66 KB, 下載次數(shù): 135)
下載附件
2022-10-24 18:09 上傳
二、dECM的三維結(jié)構(gòu)制造
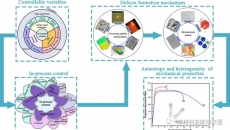
目前生物3D打印技術(shù)是dECM三維結(jié)構(gòu)制造的主流方式,以宏觀構(gòu)建仿生組織器官。但由于dECM凝膠時(shí)間長(zhǎng)且成膠后機(jī)械性能較差,研究人員在3D打印過程中通過制造裝置改進(jìn)、制造工藝優(yōu)化、制造原料加工等方式提高了dECM的打印性和打印后的形狀保真度。
1. 制造裝置改進(jìn)
(1)Scientific Reports 2017【4】:改進(jìn)3D打印機(jī)加熱裝置
簡(jiǎn)介:
韓國(guó)理工大學(xué)Jin-Hyung Shim教授團(tuán)隊(duì)開發(fā)了一種帶雙重加熱模塊的3D細(xì)胞打印系統(tǒng),用于實(shí)時(shí)加熱交聯(lián)皮膚dECM(sdECM)生物墨水,實(shí)驗(yàn)表明sdECM水凝膠的黏度、模量及可打印性隨濃度的提高而增加,而水凝膠孔隙大小與細(xì)胞活力隨濃度升高而降低。當(dāng)噴頭和底板同時(shí)加熱,sdECM的打印性顯著提高,其中2%sdECM與2.5%sdECM的形狀保真度無顯著性差異,且同時(shí)加熱打印得到的3D結(jié)構(gòu)機(jī)械性能優(yōu)于其他組。但長(zhǎng)期加熱打印會(huì)導(dǎo)致墨水干燥,會(huì)嚴(yán)重影響細(xì)胞活性和結(jié)構(gòu)穩(wěn)定性。

640-3.png (30.45 KB, 下載次數(shù): 134)
下載附件
2022-10-24 18:09 上傳
(2)Macromolecular Bioscience 2018【5】:預(yù)升溫dECM交聯(lián)后打印
簡(jiǎn)介:
薩班奇大學(xué)Bahattin Koc教授團(tuán)隊(duì)開發(fā)了牛跟腱dECM生物墨水,對(duì)比了不同增溶時(shí)間對(duì)dECM水凝膠模量、黏度的影響。打印時(shí)先將dECM水凝膠置37℃預(yù)熱6分鐘,然后采用微毛細(xì)管移取dECM水凝膠進(jìn)行擠出打印,打印過程中無任何支持結(jié)構(gòu)和/或額外的交聯(lián)劑。該方法打印出的dECM微絲形狀保真度較好,但層與層之間可能存在打印滯后及連接強(qiáng)度等問題。

640-4.png (19.9 KB, 下載次數(shù): 140)
下載附件
2022-10-24 18:09 上傳
2. 制造工藝優(yōu)化
(1)Advanced Science 2019【6】:以海藻酸鈉/黃原膠/葡萄糖內(nèi)酯材料為懸浮體系
簡(jiǎn)介:
特拉維夫大學(xué)Tal Dvir教授團(tuán)隊(duì)將患者大網(wǎng)膜組織制備成dECM生物墨水,但在打印尺寸較大、復(fù)雜度較高的結(jié)構(gòu)時(shí)發(fā)現(xiàn)dECM水凝膠弱機(jī)械性能難以支撐其重量,因此選用懸浮膠支撐dECM的3D結(jié)構(gòu),該懸浮膠主要由黃原膠和海藻酸鈉微粒組成,且內(nèi)部添加培養(yǎng)基。作為概念驗(yàn)證,他們?cè)O(shè)計(jì)了帶主要血管的心臟簡(jiǎn)易結(jié)構(gòu),打印出的心臟結(jié)構(gòu)完整性較好,可灌注,機(jī)械性能與脫細(xì)胞小鼠心臟無顯著性差異,打印結(jié)構(gòu)切片染色顯示心肌結(jié)構(gòu)及血管結(jié)構(gòu)內(nèi)部均勻分布心肌細(xì)胞與內(nèi)皮細(xì)胞。

640-5.png (17.76 KB, 下載次數(shù): 139)
下載附件
2022-10-24 18:09 上傳
(2)Bioactive Materials 2022【7】:熱塑性材料支撐dECM打印成形
簡(jiǎn)介:
韓國(guó)浦項(xiàng)科技大學(xué)Dong-woo cho教授團(tuán)隊(duì)利用3D細(xì)胞打印和骨/肌腱dECM生物墨水模擬肌腱-骨界面(TBI)制備了梯度多組織界面構(gòu)建物。這些界面構(gòu)建物在結(jié)構(gòu)、成分和細(xì)胞異質(zhì)性方面具有與天然TBI相似的梯度特征。打印時(shí)先成形PCL/PU聚合物支架,后將dECM生物墨水選擇性沉積在聚合物支架表面,逐層打印獲得8*3*1mm3的尺寸結(jié)構(gòu),然后進(jìn)行體內(nèi)外性能評(píng)估。實(shí)驗(yàn)結(jié)果表面該界面構(gòu)建物在重建梯度界面和肩關(guān)節(jié)功能恢復(fù)方面具有優(yōu)勢(shì),具有功能性肩袖再生的應(yīng)用前景。

640-6.png (24.03 KB, 下載次數(shù): 127)
下載附件
2022-10-24 18:09 上傳
3. 制造原料加工
(1)Biomaterials 2016【8】:直接加工——核黃素修飾
簡(jiǎn)介:
無顯著性差異,打印結(jié)構(gòu)切片染色顯示心肌結(jié)構(gòu)及血管結(jié)構(gòu)內(nèi)部均勻分布心肌細(xì)胞與內(nèi)皮細(xì)胞。韓國(guó)浦項(xiàng)科技大學(xué)Dong-woo cho教授團(tuán)隊(duì)開發(fā)了兩步法,使用維生素B2誘導(dǎo)的UVA交聯(lián)和熱凝膠固化心肌dECM生物墨水,使dECM 3D打印生物結(jié)構(gòu)成為可能。打印的生物結(jié)構(gòu)內(nèi)部細(xì)胞活力較高和且心臟祖細(xì)胞在內(nèi)部可增殖分化。

640-7.png (23.37 KB, 下載次數(shù): 133)
下載附件
2022-10-24 18:09 上傳
(2)Biofabrication 2021【9】:直接加工——甲基丙烯酸化修飾
簡(jiǎn)介:
俄勒岡健康與科學(xué)大學(xué)Luiz E Bertassoni副教授團(tuán)隊(duì)合成了一種可光交聯(lián)的人骨源性dECM水凝膠,以用于血管化支架的生物打印。他們將人骨碎片脫礦和脫細(xì)胞,獲得骨dECM水凝膠前體,用甲基丙烯酸酐進(jìn)一步處理修飾,獲得光交聯(lián)甲基丙烯酸化骨dECM水凝膠生物材料(BoneMA)。BoneMA具有可調(diào)諧的力學(xué)性能,其彈性模量隨著光交聯(lián)時(shí)間的增加而增加,同時(shí)保留了聚合物網(wǎng)絡(luò)的納米尺寸特征。3D打印的BoneMA支架支持內(nèi)皮細(xì)胞的血管化,并在一天內(nèi)形成相互連接的血管網(wǎng)絡(luò)。此外,他們利用數(shù)字光處理(DLP)打印技術(shù)展示了BoneMA在微尺度的可打印性。

640-8.png (41.21 KB, 下載次數(shù): 136)
下載附件
2022-10-24 18:09 上傳
(3)Advanced Functional Materials 2021【10】:直接加工——釕/過硫酸鈉修飾
簡(jiǎn)介:
韓國(guó)浦項(xiàng)科技大學(xué)Jinah Jang助理教授團(tuán)隊(duì)介紹了新型含釕/過硫酸鈉(dERS)的光固化dECM生物墨水。利用dECM內(nèi)含豐富的酪氨酸殘基的優(yōu)勢(shì),使其在可見光范圍(400-450nm)實(shí)現(xiàn)快速交聯(lián),該光引發(fā)劑的使用濃度低,可防止紫外光誘導(dǎo)的細(xì)胞內(nèi)DNA損傷,高滲透效率也有利于大尺寸結(jié)構(gòu)的整體固化。該光固化體系在dECM生物墨水中具有巨大應(yīng)用潛力,有效提高dECM生物墨水的打印精度和形狀保真度。

640-9.png (12.87 KB, 下載次數(shù): 125)
下載附件
2022-10-24 18:09 上傳
(4)Polymers 2019【10】:間接加工——混合甲基丙烯酸化聚氨酯
簡(jiǎn)介:
中國(guó)醫(yī)藥大學(xué)附屬醫(yī)院3D打印醫(yī)學(xué)研究中心謝明佑助理教授團(tuán)隊(duì)利用DLP技術(shù)制備了聚氨酯/聚多巴胺/細(xì)胞外基質(zhì)(PU/PDA/dECM)神經(jīng)導(dǎo)管,并評(píng)估了其物理特性、生物降解性、細(xì)胞相容性、神經(jīng)相關(guān)生長(zhǎng)因子、蛋白的分泌和表達(dá),以及其在允許細(xì)胞粘附和增殖方面的潛力。結(jié)果表明,PU/PDA/dECM神經(jīng)導(dǎo)管具有更強(qiáng)的親水性,可促進(jìn)細(xì)胞粘附、增殖、表達(dá)和分泌神經(jīng)相關(guān)蛋白(I型膠原和層粘連蛋白),也可以增強(qiáng)神經(jīng)源性蛋白的表達(dá),如巢蛋白和微管相關(guān)蛋白2(MAP2)。此外,PU/PDA/ECM神經(jīng)導(dǎo)管無細(xì)胞毒性,具有持續(xù)的生物降解性,并具有與PU導(dǎo)管相似的物理特性。因此,PU/PDA/ECM神經(jīng)導(dǎo)管可能成為未來神經(jīng)相關(guān)研究或臨床應(yīng)用的潛在候選材料。

640-10.png (8.77 KB, 下載次數(shù): 133)
下載附件
2022-10-24 18:09 上傳
(5)Applied Physics Reviews 2019【11】:間接加工——海藻酸鈉/普朗尼克
簡(jiǎn)介:
韓國(guó)浦項(xiàng)科技大學(xué)Dong-woo cho教授團(tuán)隊(duì)利用血管來源dECM生物墨水和儲(chǔ)蓄庫(kù)輔助的三同軸細(xì)胞打印技術(shù)構(gòu)建了血管移植物,該移植物尺寸大小與冠狀動(dòng)脈相似,并含有異質(zhì)細(xì)胞分布,制備后移植入大鼠腹主動(dòng)脈處探究其作為人工血管的可行性,結(jié)果表明所有植入物均顯示出良好的通暢度、完整的內(nèi)皮層、重塑的平滑肌和與宿主組織高匹配度。

640-11.png (24.02 KB, 下載次數(shù): 127)
下載附件
2022-10-24 18:09 上傳
(6)Acta Biomaterialia 2021【12】:間接加工——明膠/透明質(zhì)酸/甘油輔助成型
簡(jiǎn)介:
維克森林大學(xué)再生醫(yī)學(xué)研究所Sang Jin Lee教授團(tuán)隊(duì)分離豬耳廓軟骨組織并進(jìn)行脫細(xì)胞處理,隨后利用甲基丙烯酸酐(cdECMMA)加工成光交聯(lián)水凝膠,并與明膠/透明質(zhì)酸/甘油混合提高其打印性,最后與軟骨細(xì)胞混合以創(chuàng)建生物墨水。結(jié)果表明該混合生物墨水打印后的3D結(jié)構(gòu)具有足夠的力學(xué)性能和結(jié)構(gòu)完整性,并且耳廓軟骨細(xì)胞保持了活力、增殖能力且產(chǎn)生軟骨ECM成分,包括膠原蛋白和糖胺聚糖(GAGs)。

640-12.png (15.11 KB, 下載次數(shù): 141)
下載附件
2022-10-24 18:09 上傳
(7)Biomaterials 2022【13】:間接加工——PVA輔助產(chǎn)生對(duì)齊/定向纖維
簡(jiǎn)介:
維克森林大學(xué)再生醫(yī)學(xué)研究所Geun Hyung Kim教授團(tuán)隊(duì)使用了脫細(xì)胞外基質(zhì)(dECM)作為誘導(dǎo)細(xì)胞生化組分,并改進(jìn)3D細(xì)胞打印過程,利用PVA輔助產(chǎn)生單軸對(duì)齊/定向纖維結(jié)構(gòu)。打印結(jié)構(gòu)中的成肌細(xì)胞與形成的肌管結(jié)構(gòu)高度對(duì)齊,與基于甲基丙烯酸明膠(GelMA)的結(jié)構(gòu)相比, dECM結(jié)構(gòu)內(nèi)基因表達(dá)水平增加了約1.5-1.8倍。

640-13.png (30.37 KB, 下載次數(shù): 151)
下載附件
2022-10-24 18:09 上傳
總結(jié)與展望
目前,脫細(xì)胞基質(zhì)水凝膠已經(jīng)過I期臨床實(shí)驗(yàn)證明其生物安全性良好【14】,大量研究也證明其對(duì)細(xì)胞特異性分化的促進(jìn)作用,有望成為組織再生和修復(fù)的優(yōu)異材料。但其機(jī)械性能和成型能力限制了廣泛應(yīng)用,本篇文章旨在總結(jié)優(yōu)化脫細(xì)胞基質(zhì)成型加工能力的技術(shù)手段,調(diào)研結(jié)果說明,與單一材料相比,多組分材料的成型加工能力可提升范圍更廣,且具有可調(diào)諧的機(jī)械性能,是未來dECM生物墨水在3D結(jié)構(gòu)構(gòu)建中的發(fā)展方向。
參考文獻(xiàn)
【1】Choi, Yeong-Jin, et al. Journal of Materials Chemistry B, 2018, 6(35): 5530–39.
【2】Li, Shuyi, et al. Composites Part B: Engineering, 2022,234: 109620
【3】Karakaya, Ece, et al. Macromolecular Bioscience, 2022: 2200303.
【4】Ahn, Geunseon, et al. Scientific Reports, 2017,7(1):8624.
【5】Toprakhisar, Burak, et al. Macromolecular Bioscience, 2018,18(10): 1800024.
【6】Noor, Nadav, et al. Advanced Science, 2019,6(11):1900344.
【7】Chae, Suhun, et al. Bioactive Materials, 2023,19 (1): 611–25.
【8】Jang, Jinah, et al. Acta Biomaterialia, 2016, 33 (3): 88–95.
【9】Parthiban, S Prakash, et al. Biofabrication 2021, 13(3):035031.
【10】Kim, Hyeonji, et al. Advanced Functional Materials 2021, 31(32): 2011252.
【11】Gao, Ge, et al. Applied Physics Reviews 2019,6(4): 041402.
【12】Visscher, Dafydd O, et al. Acta Biomaterialia, 2021, 121: 193–203.
【13】Kim, WonJin, et al. Biomaterials, 2022, 230: 119632.
【14】Traverse, Jay H, et al. JACC: Basic to Translational Science, 2019, 4(6): 659–69.
|
上一篇:香港理工大學(xué)趙昕、梅全靜等 | 機(jī)械拉伸3D水凝膠誘導(dǎo)神經(jīng)干細(xì)胞的分化下一篇:中南大學(xué)增材制造頂刊:金屬基金剛石復(fù)合材料PBF-LB中磨料熱演化和石墨化的研究
|